肠球菌(Enterococcus)是肠道中的一种共生细菌,广泛分布于自然环境中,包括水、土壤、蔬菜肉类等食物和昆虫、鸟类、鱼类、哺乳动物等野生动物的肠道及粪便中。从20世纪70年代开始,肠球菌感染的发生率和致死率都大大上升。由于这些肠球菌拥有很强的耐药性并且很容易获取新的耐药基因,肠球菌感染往往很危险,现在已成为医院里最主要的多重耐药细菌感染源之一。由耐药性肠球菌而引发心内膜炎、尿路感染和菌血症而导致的患者死亡率可高达25%以上。
细菌蛋白外毒素是很多致病细菌的主要武器。获得毒素基因往往是“良性”细菌演变成人和动物的主要病原菌的关键一步,比如非致病白喉杆菌可以通过噬菌体感染获得表达白喉毒素的基因从而变成致病菌。肠球菌中以往并没有发现专门针对人和哺乳动物细胞的蛋白毒素。本研究首次发现和验证肠球菌获得了针对人和哺乳动物细胞的蛋白毒素,揭示了肠球菌在毒力和致病机理方面令人担忧的潜在演化,值得高度警惕。
蛋白毒素的发现传统上是从研究已知疾病和病原菌入手,然后找到致病的毒素。很多人类的致病细菌和病毒都演化于自然界中,传统研究往往受限于被动等待微生物获取某种对人致病的能力以及等待临床诊断上建立起某种疾病和微生物的联系。这次的重大发现则是起始于从野外采集分离各种肠球菌菌株并进行大规模基因组测序,通过生物信息学分析找到潜在的新毒素基因,然后再通过结构和宿主受体的研究在分子水平上直接阐明毒素的功能和宿主特异性。这项研究充分运用了当前“后基因组时代”对微生物毒力因子和潜在致病机理的研究新途径,直接揭示了潜在病原菌和致病毒力因子的存在和机理,提供了先发治“菌”的可能性,为防治未来新兴病原菌做好准备。
这项研究的主要合作者,哈佛医学院和博德研究所 (Broad Institute)的Michael Gilmore 教授领导的研究组在美国国立卫生研究院资助下,长期从事对肠球菌菌株的采集和基因组测序工作。董民实验室和Michael Gilmore实验室合作于2018年在一个采集自美国蒙大拿州野外马粪中的肠球菌菌株中,找到了编码新的穿孔毒素的基因。通过进一步的生物信息学分析发现一共有8个类似的毒素(Epx1-8),构成一个特有的毒素家族。这些毒素目前已经在近年来分离的46种肠球菌菌株中发现(包括分属于E.faecalis,E. faecium和E.hirae三大类)。这些菌株的来源包括人和动物粪便、超市鸡肉、废水,和人的组织样品等,其分布地点遍布全球五大洲 。
穿孔毒素是细菌的常见毒素类型。被细菌以单体形式分泌出来以后,它们会在宿主细胞膜上聚集并形成跨膜穿孔通道(pore)。穿孔毒素可以破坏宿主上皮屏障、杀死免疫细胞及组织细胞, 因此是很多病原菌的重要致病因子。典型的穿孔毒素比如α型溶血素(α-Hemolysin; Hla),是金黃色葡萄球菌(Staphylococcus aureus)中重要的致病因子。以α型溶血素为代表的这一类穿孔毒素通常由7个单体聚合形成一个β桶(β-barrel)跨膜穿孔通道,其经典结构早在1996年就通过晶体结构生物学方法解析。为了探究Epx的分子机制,董民实验室与哈佛医学院的Jonathan Abraham实验室和吴皓教授实验室合作,通过晶体学和冷冻电镜的方法分别解析了Epx1和Epx4的结构。结果证实Epx1和Epx4属于β桶穿孔毒素家族(β-barrel pore-forming toxin family)。其整体结构与传统的α型溶血素家族成员比较像,包含由β-sandwich区域构成的cap结构域、芳香族氨基酸富集的疏水性rim结构域和由β桶形成跨膜穿孔通道stem结构域。有意思的是,与传统β桶穿孔毒素家族形成的七聚体穿孔通道不同,Epx1和Epx4都形成了八聚的穿孔通道结构。另外一个和已知穿孔毒素不同的地方是Epx1和Epx4都在膜外结构域上方形成了一个额外的β桶结构 (命名为 “Top”结构域)。对Top结构域的几个关键氨基酸残基的突变研究表明这个结构域对Epx穿孔通道的形成和稳定发挥了重要作用。这些特有的结构特征证实Epx毒素形成β桶穿孔毒素家族中的一个独特的分支。
作者进一步通过细胞实验揭示了上述马粪菌株所产生的Epx2是毒性最强的穿孔毒素之一,只需要11-14 ng/mL 就可以杀死一半的HeLa细胞(IC50)。同时,他们发现Epx2表现出了一定的宿主物种选择性,对人源和猴源细胞的毒性较高,而对狗源和鼠源细胞毒性较低。为了更深入地了解Epx2作用于人源细胞的分子机制,作者通过CRISPR-Cas9介导的全基因组筛选鉴别出了细胞表面的组织相容性复合物 I (major histocompatibility complex I, MHC-I,人源蛋白又称作人白細胞抗原复合体I ,human leukocyte antigen, HLA-I) 为其特异性受体。另一毒素成员Epx3也利用MHC-I/HLA-I作为受体。这两种毒素都可以识别人源、马源、猪源、牛源的MHC-I,而对鼠源的MHC-I识别较弱。这些发现在分子水平上解释了Epx2和Epx3对宿主的选择特异性。
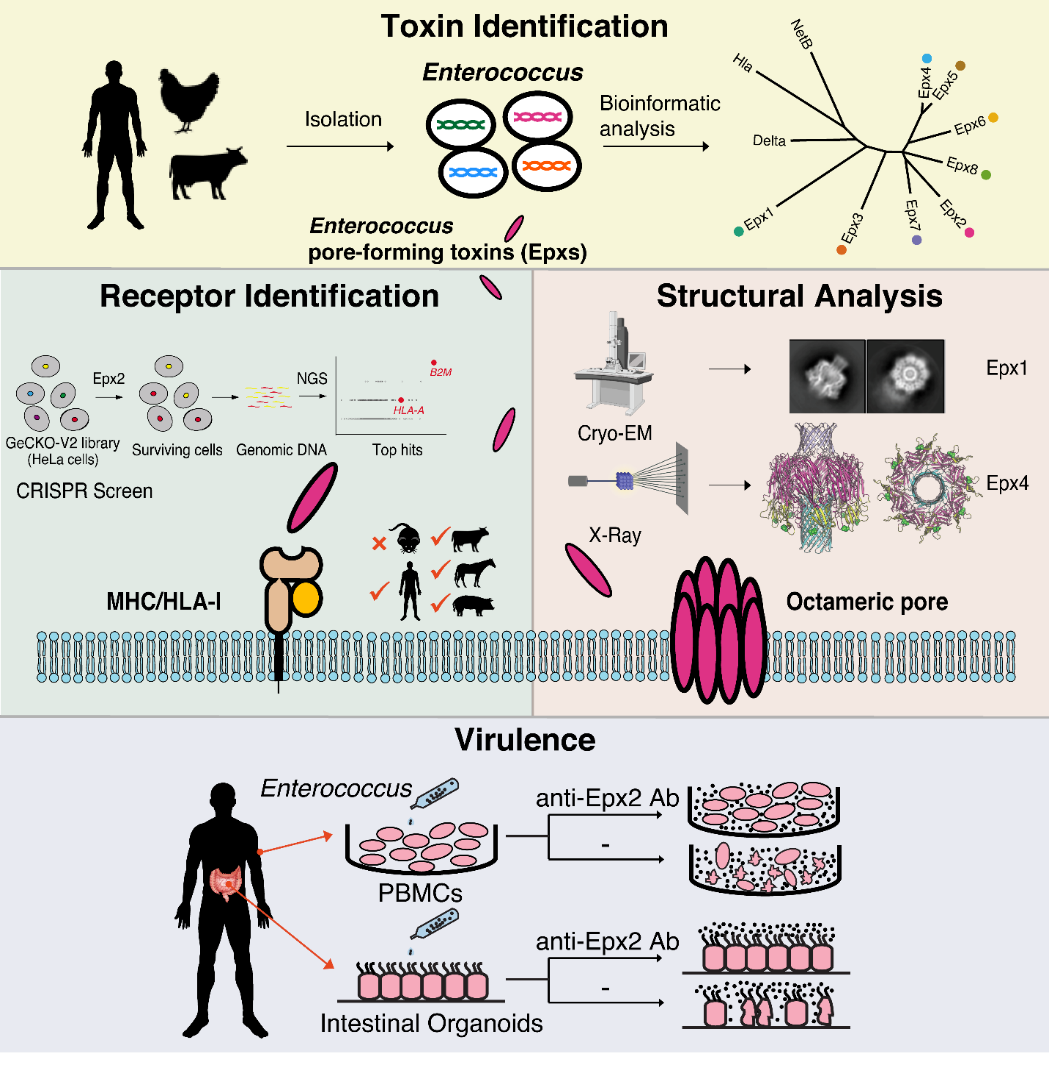
图一:文章图示摘要
为了探究这些毒素在肠球菌致病过程中的功能机制,作者把携带有Epx2基因的肠球菌株DIV0147和人源的外周血单核细胞(Peripheral Blood Mononuclear Cells,PBMC)以及人源的肠道类器官(human intestinal organoids)进行体外共培养。结果显示,DIV0147肠球菌对外周血单核细胞以及肠道类器官造成了严重损伤。加入针对Epx2的特异抗体则可以完全中和毒性并保护这些细胞。这些发现揭示DIV0147肠球菌通过分泌Epx2来毒杀人源细胞,证实了含有毒素的肠球菌的潜在致病性 (图一)。
作者提到当前研究的主要局限性是尚不知道有何种人或动物的疾病是由这些新发现的毒素和含毒素的菌株所造成的, 这将是未来研究中的重要问题, 也希望这些新型毒素的报道可以推动对其疾病相关性的进一步调查研究。
转自网络如有侵权请联系删除!





