心肌梗死(myocardial infarction,MI)是患者冠状动脉发生缺血缺氧所引起的心肌坏死,其发病迅速、病情凶险,常可危及生命。该疾病在欧美最常见,美国每年约有150万人发生心肌梗死。中国近年来呈明显上升趋势,每年新发至少50万。急性心肌梗死发生时心肌细胞的血氧不足,缺血心肌的多种炎症因子被大量释放,促进心室重构,进而导致心脏肥大。这一过程中肾素-血管紧张素-醛固酮系统(renin angiotension aldosterone, RAAS)的过度激活发挥了重要作用。血管紧张素Ⅱ通过刺激成纤维细胞,产生胶原蛋白,促进心肌细胞肥大和心肌纤维化,从而形成心脏瘢痕组织。虽然瘢痕形成可预防心肌梗死后心脏破裂,但瘢痕组织往往缺乏弹性,限制心脏的高效跳动能力,引起血流动力学功能障碍和心律失常,从而导致心力衰竭。临床上已将心肌梗塞后瘢痕组织的大小作为心血管预后的独立预测指标,疤痕组织尺寸越大的患者出现心率问题、心力衰竭和心脏猝死的风险就越大。因此,科学家一直致力于探究如何减少瘢痕组织的形成,恢复心肌梗死后梗死灶的功能。
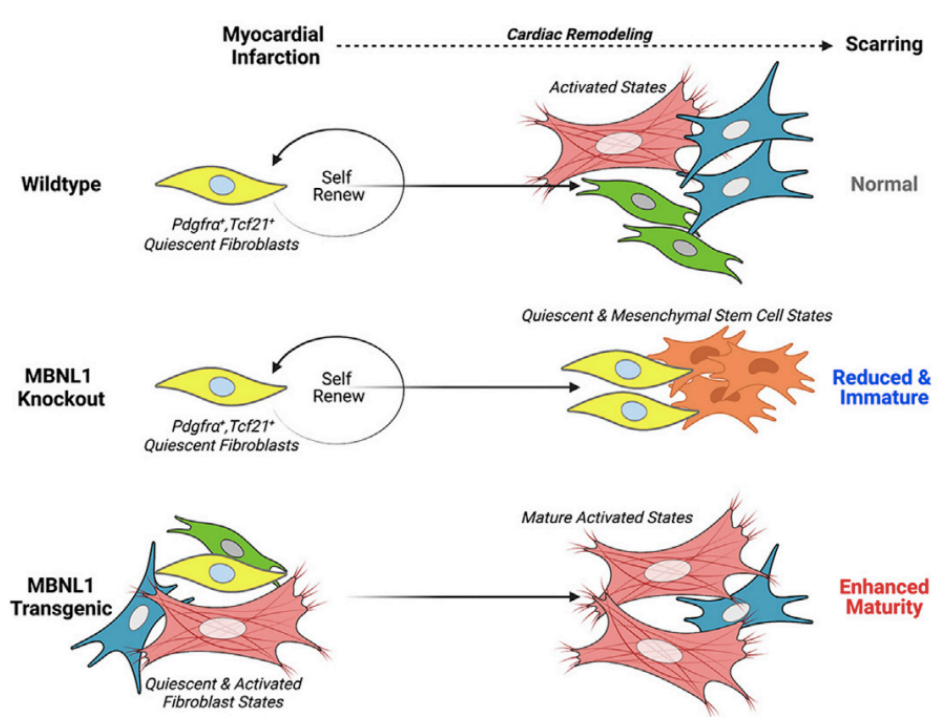
肌成纤维细胞活化状态与纤维化瘢痕的产生、成熟以及心肌重塑有关,而动态成纤维细胞向肌成纤维细胞状态过渡是心脏纤维化反应的基础。近日,来美国华盛顿大学的Jennifer Davis团队在Cell Stem Cell杂志在线发表了题为MBNL1 drives dynamic transitions between fibroblasts and myofibroblasts in cardiac wound healing的研究论文,揭示了在心脏创伤愈合过程中控制成纤维细胞状态可塑性的分子开关MBNL1。作者发现,MI发生后,MBNL1的表达调控心脏成纤维细胞的增殖以及向肌成纤维细胞活化状态的过渡和维持。该研究为研发治疗心肌梗死的药物提供了新思路和理论基础。

肌成纤维细胞状态是不稳定并可逆的,而这些状态转变的关键控制点是转录组成熟,它主要由RNA结合蛋白介导,如muscleblind-like 1(MBNL1)。MBNL1 通过稳定、剪接、多腺苷酸化和定位其靶标 mRNA 来调节转录组。作者前期研究显示,MBNL1缺失小鼠的心脏在损伤后肌成纤维细胞密度和纤维化瘢痕形成均有所下降。同时,在成纤维细胞向肌成纤维细胞的转化过程中,血清反应因子(serum response factor, SRF)和钙调神经磷酸酶(calcineurin, can)等转录本是必需的,而它们受到MBNL1的调控。这些数据共同表明MBNL1在驱动心脏纤维化前期状态和纤维化中发挥重要作用,但这尚未在体内得到明确证明。因此,作者在本研究中对上述推论进行了深入探究。
首先作者在Postnlineage reporter mice(PostniCre-mT/mG,可以通过流式细胞仪分选不同状态的成纤维细胞)中比较了静息态成纤维细胞和心肌成纤维细胞的基因表达情况。与未标记的静息态成纤维细胞相比,在MI发生后的所有时间点中,Postn-traced成纤维细胞中的一些经典的肌成纤维细胞标志基因显著上调,包括Col1a1和Acta2。随后,作者检测了Mbnl1的表达情况。结果显示,与静息态的成纤维细胞相比,Postn-traced肌成纤维细胞中的Mbnl1基因表达水平显著升高。此外,作者还检测了来自心衰心脏(富含肌成纤维细胞的一种组织来源)的成纤维细胞,Mbnl1和Acta2显著上调。这些数据表明在人和小鼠中,MBNL1的活性与肌成纤维细胞的形成相关。
那么MBNL1是否可以将心脏成纤维细胞(cardiac fibroblasts)转化为肌成纤维细胞(myofibroblasts)呢?作者通过MBNL1条件性转基因小鼠(MBNBL1 Tg-Tcf21iCre),在心脏成纤维细胞中特异性地诱导过表达MBNL1。通过FACS(fluorescence-activated cell sorting)分选心脏成纤维细胞,随后进行RNA-seq测序和分析,鉴定出了420个差异表达(differential expression, DE)基因(MBNBL1 Tg-Tcf21iCrevs. NTG-Tcf21iCre)。在没有发生损伤时,MBNL1的过表达足以将心脏成纤维细胞转录组转化为肌成纤维细胞转录组。与NTGs对照相比,在未损伤的MBNL1 Tg-Tcf21iCre成纤维细胞中,肌成纤维细胞转录标记物(Acta2、Postn、Fn1、Lox和Col5a2)包含在前25个DE基因中。尽管MBNBL1过表达成纤维细胞具有促纤维化肌成纤维细胞转录组,但两组小鼠的心肌纤维化程度、aSMA+肌成纤维细胞数量、心脏结构和功能均无明显差异,因此作者推测需要额外的刺激来实现生理肌成纤维细胞表型。
为了展示出纤维化表型,作者对MBNL1 Tg-Tcf21iCre和NTG小鼠进行了MI处理。与来源于NTG小鼠的心脏成纤维细胞相比,MI显著地上调了MBNL1 Tg-Tcf21iCre小鼠(简称“Tg小鼠”)中的多个胶原基因(包括Col1a1,Col1a2,Col3a1,Col5a1和Col5a2)。与NTG小鼠相比,Tg小鼠心脏边界区的胶原纤维变短,缩短分数(fractional shortening)降低10%,并呈现出微弱的心室扩张。有研究表明衰老MBNL1 Tg-Tcf21iCre小鼠在无损伤情况下促进间质纤维化,因此,作者先对MBNL1 Tg-Tcf21iCre和NTG小鼠进行MI处理,待梗死瘢痕完全形成时(约3个月)再进行检测。虽然两种小鼠中的纤维化瘢痕形成面积、肌成纤维细胞密度和心肌重构依旧没有明显差异,但Tg小鼠中的瘢痕组织更成熟,这种增强的疤痕成熟与基质成熟因子(如Lox和Runx1)的表达增加一致,说明MBNL1可以增加瘢痕组织的稳定性。过表达的MBNL1可能通过两种方式限制肌成纤维细胞数量:诱导凋亡或抑制伤口愈合的增殖阶段。TUNEL染色显示两组小鼠中的成纤维细胞凋亡并没有明显区别,而细胞增殖检测发现,Tg小鼠的心脏成纤维细胞的增殖与NTGs相比降低了20%左右,说明MBNL1会抑制MI诱导的心脏成纤维细胞的增殖。
随后,作者在小鼠心脏成纤维细胞中特异性地敲除了MBNL1(MBNL1Fl/Fl-Tcf21iCre小鼠,简称为Fl-Tcf21iCre),用于检测MBNL1在心脏成纤维细胞向肌成纤维细胞状态转化中的作用。在正常状态下,心脏成纤维细胞特异性MBNL1缺失并不影响心脏功能,但在MI发生后,对照组小鼠(MBNLFl/Fl)会出现心室扩张的表型,而Fl-Tcf21iCre小鼠不会发生心室扩张。同时,Fl-Tcf21iCre小鼠中的纤维化和肌成纤维细胞密度比对照组减少了40%左右,说明在肌成纤维细胞的形成和纤维化过程中MBNL1是必要的。作者还发现Fl-Tcf21iCre心脏的胶原纤维宽度和排列也降低了,说明敲除MBNL1会阻碍瘢痕组织的成熟和稳定。MBNL1Fl/Fl和Fl-Tcf21iCre小鼠进行MI处理后,用EdU标记增值细胞,作者发现在Fl-Tcf21iCre小鼠心脏中,增殖细胞约占45%,对照组约为31%。由于增殖加强通常与去分化有关,因此作者进行了心脏成纤维细胞转录组分析,进而探究敲除MBNL1是否可以促进损伤响应中的去分化。与MBNL1Fl/Fl组相比,Fl-Tcf21iCre成纤维细胞中的一些心脏成纤维细胞特异性转录本显著降低。同时,已有研究显示,EMT(epicardial to mesenchymal transition, 心外膜向间充质过渡)的其他驱动因素,如Zeb1和Slug以及心外膜发育基因Aldh1a2,Aldh1a1和Tbx18,也在Fl-Tcf21iCre心脏成纤维细胞中上调,表明MBNL1缺失的心脏成纤维细胞比野生型更具可塑性。
EMT调节基因表达的改变并不能最终确定这些信号是否与MBNL1在成纤维细胞命运或心外膜的重新激活有关,因此,作者进行了单细胞测序实验(single cell RNA-seq, scRNA-seq)。他们期望在MBNL1细胞群中出现一种独特的具有心外膜祖细胞特征或扩张特征的成纤维细胞亚状态。出人意料的是,Fl-Tcf21iCre心脏成纤维细胞群中心外膜和心外膜/间皮细胞簇完全不存在,而这些心外膜细胞群在NTGs中扩大,作者认为这是心肌梗死后第1至5天内发生的正常心外膜重新激活和扩大。随后,通过联合分析scRNA-seq和RNA-seq数据,作者对MBNL1-Tg和MBNL1-null心脏成纤维细胞进行了比较,发现MBNL1功能的获得和丧失导致了完全相反的命运决定,证明MBNL1作为转录后开关调控成纤维细胞和肌成纤维细胞状态的转换。
最后,作者对MBNL1如何驱动MI后心脏成纤维细胞状态发生改变进行了探索。作者根据以下3个标准进行了数据挖掘: MBNL1结合因子,肌成纤维细胞分化的诱导因子和MI后的Fl-Tcf21iCre心脏成纤维细胞中下调的转录因子。最终筛选了唯一能够同时满足这3个标准的基因Sox9(一种对 EMT 和肌成纤维细胞形成至关重要的转录因子)。与损伤后的静息态成纤维细胞相比,损伤后的肌成纤维细胞中的Sox9表达上调了8.5倍;相反,Sox9阳性的成纤维细胞的百分比在心肌梗死Fl-Tcf21iCre心脏中下调了2.5倍。在MBNL1Fl/Fl和Fl-Tcf21iCre心脏成纤维细胞中转染Sox9足以诱导aSMA阳性肌成纤维细胞,说明Sox9可以独自促进肌成纤维化状态,进而在MBNL1-null成纤维细胞中拯救分化缺陷。那么MBNL1是否可以稳定Sox9转录本?作者在MBNL1Fl/Fl和Fl-Tcf21iCre心脏成纤维细胞中进行了mRNA衰减实验。结果显示,Fl-Tcf21iCre成纤维细胞中Sox9的表达比BNL1Fl/Fl对照组中的少53%,说明Fl-Tcf21iCre心脏成纤维细胞中的转录本衰减更快。在MBNL1Fl/Fl和Fl-Tcf21iCre心脏成纤维细胞中表达MBNL1均可以上调Sox9的表达水平。这些数据表明,心肌梗死后,MBNL1通过稳定心肌成纤维细胞中的Sox9转录本,进而促进肌成纤维细胞状态转变。
总的来说,该研究显示MBNL1通过调节损伤诱导的成纤维细胞状态动态,进而调控不良的心肌重构和纤维化瘢痕的性质。控制肌成纤维细胞可逆性的能力为解决纤维化的临床负担带来了很大的希望,因为通过药物或遗传手段防止肌成纤维细胞活性的诱导和维持可以显著防止心脏和其他组织的纤维化重塑。靶向成纤维细胞可塑性背后的转录后机制是一种很有前景的方法,因为大约1/3的基因表达变化受转录后调节的影响。作者认为MBNL1具有良好的治疗性能,因为它调节心脏创伤愈合和修复所需的成纤维细胞功能的多个层面,但依旧还需要更多的研究来了解MBNL1在其他模型(如慢性应激)中调节细胞状态转变的作用。同时,作者认为在Sox9机制方面还缺乏体内证据来证实Sox9可以拯救心脏的纤维化反应,这一信息将有助于更好地理解RNA结合蛋白在控制心肌纤维化中的治疗潜力。
转自网络如有侵权请联系删除!





