作为一种恶性程度非常高的肿瘤,肝癌在全世界范围内的发病率和死亡率都位居前列。我国国家癌症中心最新数据显示,肝癌导致的死亡排名第二位,是我国人民极大的健康负担。其中,肝细胞癌(HCC)是肝癌的主要亚型,占据原发性肝癌的75%-85%。针对HCC治疗策略的开发和改进一直是迫切的临床需求。
众所周知,针对PD-1和CTLA-4的免疫检查点抑制剂(ICB)已被广泛用于癌症治疗,对多种晚期癌症有疗效。ICB单药的临床数据显示,纳武利尤单抗和帕博利珠单抗分别在晚期HCC患者治疗中达到15%和18.3%的客观缓解率(ORR)。但同时,ICB在约20%的患者中引起了3级或以上的免疫相关不良事件(irAE)。
联合免疫疗法虽然提高了HCC患者的ORR,但irAEs发生率也随之增加。例如,抗PD-1联合抗CTLA-4的ORR为31%,3/4级irAEs的发生率为37%;抗PD-L1联合抗血管内皮生长因子-A(VEGF-A)的ORR为27.3%,3/4级irAEs的发生率为56.5%。因此,要改善HCC患者的免疫治疗结果,就必须先消除ICB的副作用。
近日,由新加坡国立癌症中心的David Tai和新加坡国立大学的Valerie Chew领衔的团队,在Journal of Hepatology期刊发表重要研究成果 。
通过深度单细胞免疫分析,他们发现HCC患者的血液样本中不同的抗原递呈细胞(APC)和效应记忆T细胞(TEM)亚型,可作为区分ICB应答和副作用的生物标志物。而通过控制仅影响ICB副作用产生的免疫通路,他们在小鼠模型中证实,TNFR2抑制可以在保证ICB治疗效果的同时消除免疫治疗的副作用。
研究人员首先收集了在新加坡接受抗PD-1治疗的HCC患者(以下简称SG组)治疗前和治疗中的血液样本,通过质谱流式细胞术(CyTOF)和单细胞测序研究了ICB应答和irAEs的发生机制以及生物标志物。接下来他们进行了多轮验证,包括收集来自韩国的HCC患者样本(以下简称KR组)作为独立验证组,用流式细胞术验证他们从SG组分析中发现的生物标志物,对SG组治疗前和治疗后1周的肿瘤活检样本进行批量测序分析,最后使用小鼠HCC模型进行治疗验证。
研究者们对所有患者(SG+KR)进行了两种分组。根据ICB治疗结果,患者被分为有反应者(Res,即部分缓解[PR]或疾病稳定[SD]≥6个月的患者)和无反应者(Non-Res,即6个月内有疾病进展的患者)。6个月的时间点是根据Checkmate040研究判定,其结果显示接受纳武利尤单抗治疗的HCC患者中,SD≥6个月的患者占比37%。
根据是否有过irAEs副作用发生,患者被分为不良反应组(Tox,即经历过2级[G2]或以上irAE的患者),和无不良反应组(non-Tox,即经历过G1或无irAE)。值得注意的是,G2 irAE是考虑干预或中断ICB的指标。为了找到可以在治疗早期预测ICB应答或筛查irAEs高风险患者的生物标志物,研究者们选取了SG组中治疗前和治疗早期(<6周)的样本(n=21)。
通过分析6个Res与六个Non-Res样本的CyTOF结果,研究者们发现了三个在Res组中富集的T细胞簇:FoxP3+CD4+T细胞(C33),FoxP3+CTLA4+CD4+调节性T细胞(Treg)(C3),以及CD8+CD45RO+CCR7-CXCR3+TEM(C76)。此外,他们还发现了两个不同的CD11c+髓细胞簇,在Res组富含的HLADRhiCD86+APC簇(C4),和在Non-Res组富含的CD14+HLADRlo/-,疑似髓源性抑制细胞簇(MDSCs)(C37)。
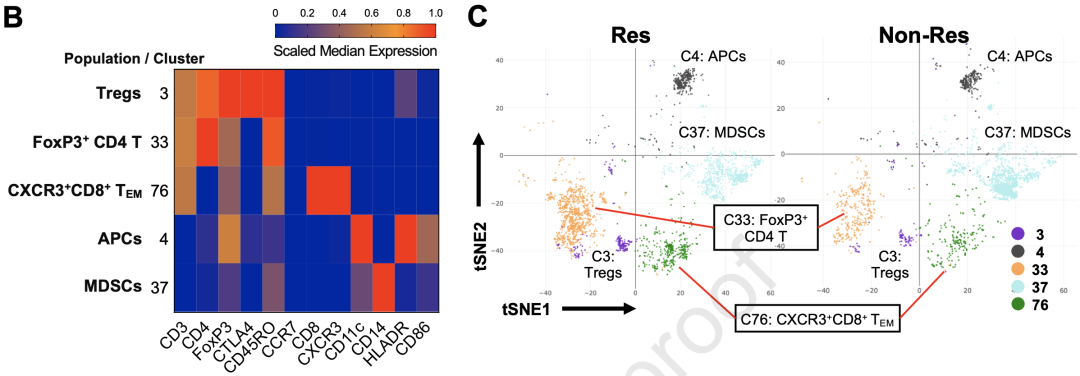
ICB Res和Non-Res患者的血液中有不同免疫细胞亚型
接下来,研究者们用流式细胞术对SG和KR组样本进行了验证,对ICB有较好反应的Res组患者血液中普遍有更多Treg,APC,和CXCR3+CD8+TEM细胞。此外,多变量分析显示,这些生物标志物与Res组更好的无进展生存期(PFS)显著相关。其中CXCR3+CD8+TEM和APC的富集是PFS的独立预测因子。更重要的是,irAEs分组后的分析显示,CXCR3+CD8+TEM和APC仍然在SG和KR两组的Res患者中显著富集,尤其是在Non-Tox患者中。这些数据表明,外周血CXCR3+CD8+TEM和APC是HCC ICB治疗预后的独立预测因子。
接下来,研究者们分析了在Tox患者irAEs发生期间或±两周内采集的血液样本,并与在相同时间点采集的Non-Tox患者样本进行了对比。结果显示,Tox组的血样中富含两个CXCR3+CD38+CD16+CD56+NK细胞簇(C89,C99),而Non-Tox患者血样则富含三个CD8+T细胞簇,两种TEM(CD45RO+CCR7-;C66,C76)和粘膜相关不变T(MAIT)细胞(V⍺7.2+CD161+CD56+CD8+,C96),以及一个髓细胞簇(CD11c+CD14+HLADR+,C27)。流式细胞术的验证结果也显示出相同的趋势。
有趣的是,前文所提到的在Res组中发现的CXCR3+CD8+TEM(C76)同样在Non-Tox组中富集。在不考虑ICB应答的情况下,以上五种免疫亚群(NK,CD8 T,TEM,MAIT,APC)代表了与irAEs相关的生物标志物。
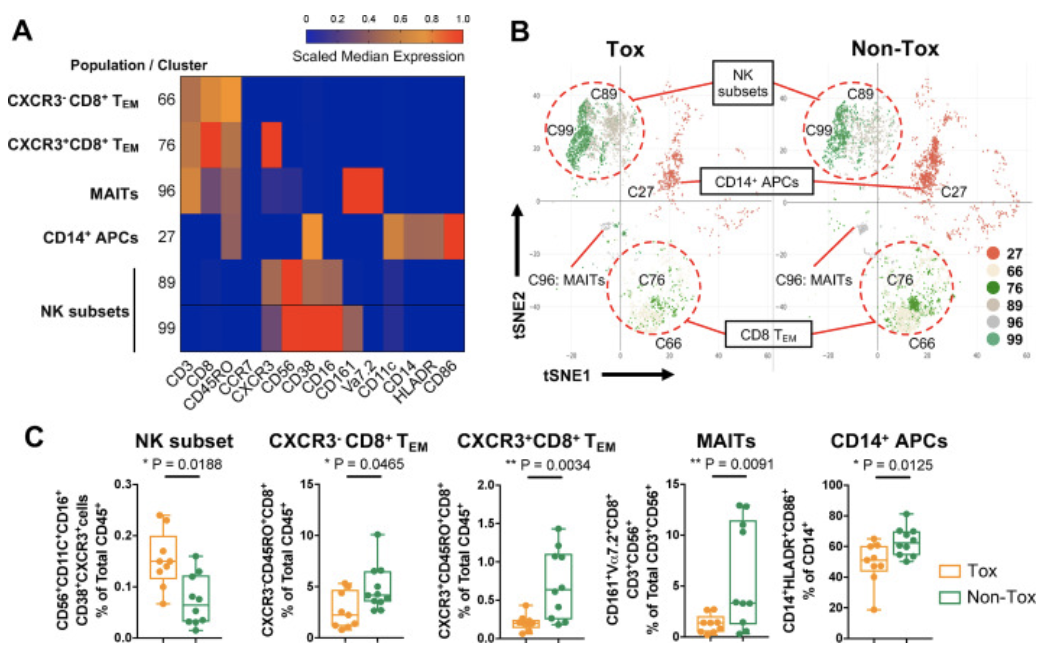
与ICB副作用相关的外周血免疫细胞
为了更深入地了解上述免疫亚群,研究者们对10个外周血样本进行了单细胞测序,其中包括9个治疗中期样本(6个Res和3个Non-Res;5个Tox和4个Non-Tox)和一个治疗前样本(Res/Tox)。利用差异基因表达分析(DEG),他们从59980个单细胞中识别出了29个簇。其中,Treg(CD3D+CD4+FOXP3+CTLA4+IL2RA+)簇,和表达ITGAX(CD11c),HLA-DPA1,THBD(CD141)和CLEC9A的常规I型树突状细胞(cDC1)APC簇,在Res中显著富集。两个表达CD14和ITGAX(CD11c)的髓细胞簇,CD14-1和CD14-3,则与Non-Tox相关。研究者们还发现,这些CD14+簇高表达KLF4和CLEC7A,这是巨噬细胞向免疫抑制性极化的标志。
为了破译ICB应答和irAE这两个不同临床指标背后的免疫机制,研究者们将目光转向了与这两种事件都相关的CD11c+APC。Res患者富集的cDC1簇表达了高水平的HLA相关基因,表明这些细胞具有优秀的的抗原呈递能力。CD11c+APC的基因集富集分析(GSEA)也验证了这些细胞的功能性,这些细胞的转录组富集了包括抗原加工和MHC II类呈递,T细胞共刺激,干扰素-γ信号传导等重要的免疫启动相关基因集。与Non-Tox相关的其他两个髓细胞簇(CD14-1和CD14-3)的对比显示,CD14-1比CD14-3表达了更高水平的抗原呈递HLA相关基因,而CD14-3则表达了更高水平的免疫抑制性细胞受体STAB1(Clever-1)GSEA分析也显示,相对于CD14-1,与Non-Tox更显著相关的CD14-3减少了抗原呈递和炎症特征的基因集,因此更具备免疫抑制性表型。
研究者们也对前文中与ICB应答和irAEs相关的重要CD8+T细胞簇(CXCR3+TEM)进行了单细胞测序分析。他们发现,与所有其他T细胞相比,CXCR3+TEM上调了包括抗原呈递,HLA(s),炎症,颗粒酶,和细胞增殖的多个基因,例如MKI67。相反,CCR7,IL7R和LEF1等幼稚T细胞基因在CXCR3+TEM中表达下调,表明这些T细胞有效应记忆表型。GSEA分析也不出所料的呈现出包括炎症反应,细胞溶解,抗原加工以及通过MHC II类呈递等基因集在CXCR3+TEM中富集。
这些结果都显示,与其他T细胞相比,CXCR3+CD8+TEM呈现出强炎症和细胞溶解力表型。
鉴于全身免疫是一个动态的系统,各种细胞串扰都可能影响整个大环境的免疫功能,研究者们还使用CellPhoneDB[11]对CXCR3+CD8+TEM转录组中受体和配体的表达进行了识别,以预测它们与其他免疫细胞的通讯。
他们发现,可促进炎症和肿瘤发生的三种受体,淋巴毒素α(LTA)受体,肿瘤坏死因子受体超家族(TNFRSF1A,1B),和淋巴毒素β受体(LTBR)[12]均在Res和Tox组的CXCR3+CD8+TEM细胞样本中富集。也就是说,这些细胞擅长与其他细胞形成促炎相互作用,从而导致ICB应答和irAEs。
此外,研究者们还观察到CXCR3+CD8+TEM和髓细胞群之间存在明显的TNF相互作用。Res患者的TEM和APC之间主要进行的是TNF-TNFRSF1B(TNFR2)信号传导,Non-Tox患者则是TNF-TNFRSF1A(TNFR1)信号传导。TNF与TNFR1和TNFR2的相互作用在巨噬细胞活化和炎症中有着重要角色。
研究者们用流式细胞术测定了TNF⍺,TNFR1,和TNFR2的蛋白质表达。他们发现,Res组的CXCR3+CD8+TEM细胞比Non-Res组表达了更高的TNF⍺。
在髓细胞的对比中,Non-Tox组的CD14+单核细胞和CD14-CD11c+HLA-DR+树突状细胞(DC)比Tox组增加了TNFR1表达。而对比Res和Non-Res组时,研究者们发现单核细胞和DC上的TNFR2表达没有显著差异。
也就是说,ICB应答(Res)中TNF信号作用的增加主要是由TNF⍺上调驱动的,而在没有irAEs(Non-Tox)的患者中,主要是由于TNFR1表达增加。这表明,我们可以利用不同的TNF信号通路来解耦ICB应答和irAEs的产生,在保留治疗效果的同时抑制副作用的发生。
为了验证这个假设,研究者们用小鼠模型进行了抗PD-1和/或抗TNFR1或抗TNFR2的治疗试验。
经过四轮治疗,肿瘤结节在所有联合治疗组的小鼠中都显著减少,而接受抗PD-1+抗TNFR2联合治疗的小鼠肿瘤负荷为零。
研究者们还观察到,抗PD-1+抗TNFR1治疗组小鼠的肝脏/体重比显著增高,而小鼠没有体重或肿瘤负荷上的明显变化,这侧面说明了这组小鼠表现出了肝脏肥大和炎性副作用。这项结果也证实了研究者们之前在Non-Tox患者中观察到的TNFR1增加有防止irAEs的保护作用。令人惊喜的是,抗PD-1+抗TNFR2治疗组的小鼠副作用水平和对照组一致,并成功清除了肿瘤,这些结果给研究者们的假设提供了有力的支持。
研究者们认为,TNFR2抑制之所以能在保护ICB作用的情况下降低副作用炎性反应,是因为TNFR2优先表达于高免疫抑制型Treg细胞上。为了验证这个假设,研究者们从患者外周血,非肿瘤肝脏,和HCC样本中分选了Treg和肿瘤浸润淋巴细胞(TIL)进行对比。他们发现,与TIL中的其他细胞相比,Treg的TNFRSF1B(TNFR2)表达显著高于TNFRSF1A(TNFR1)。与来自外周血的或非肿瘤肝脏组织的Treg相比,TIL-Treg的TNFRSF1B表达也显著增高。这些发现证明,TNFR2特异表达于HCC TIL中的Treg细胞,抑制后可以增强抗肿瘤反应,并不会增强全身副作用。
此外,研究者们还在所有抗PD-1治疗组(单药或联合治疗)的小鼠肿瘤中观察到了CXCR3+CD8+T细胞和CD11c+MHCII+XCR1+cDC1细胞数量的增加。前文提到,这些免疫亚型是HCC患者外周血中与ICB应答相关的生物标志物,相似的免疫亚型或是小鼠肿瘤浸润中起到关键抗癌作用的细胞。
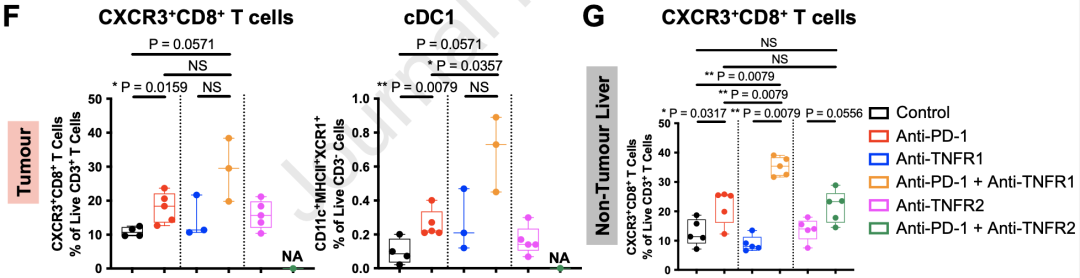
小鼠肿瘤浸润免疫细胞
总的来说,这项研究成果揭示了HCC患者外周血TEM和APC与ICB治疗应答和irAEs都有重要关系,免疫应答和irAEs反应是由TEM和APC之间不同的TNF信号通路所促成的。因此,通过阻断造成irAEs的TNFR2信号传导可实现ICB副作用的消除,这对未来HCC患者的ICB疗效早期检测和联合免疫疗法的改进都有重要的意义。
文章转自网络,如有侵权请联系删除。





